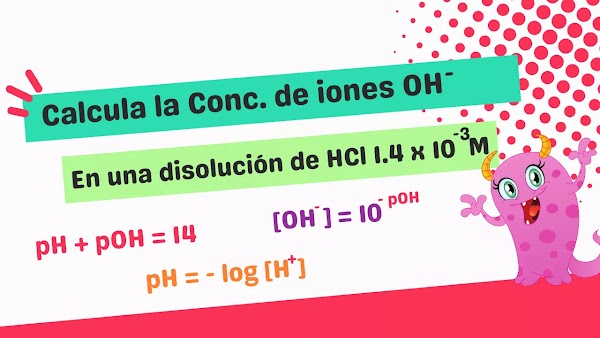
Calcule la concentración de iones OH- en una disolución de HCl 1.4x10-3 M
Video tutorial
Respuesta.
Cabe mencionar que el agua se ioniza en H+ y OH-, cuando el HCl se mezcla con agua los iones de H+ aumentan
obviamente, por ello podemos usar la fórmula;
pH + pOH = 14
Cuando el HCl se mezcla con
Agua
la reacción es la siguiente:
HCl + H2O ---> H3O + Cl- Recordar que H3O se puede expresar también como H+ y para calcular pH de esta solución se usa la fórmula;
pH = - log [H+]
pH = - log [1.4x10-3 M]
pH = 2.85387
pH = - log [1.4x10-3 M]
pH = 2.85387
Podemos usar la siguiente formula para calcular el pOH
pH + pOH = 14
De ésta formula despejaremos pOH
pOH = 14 - pH
pOH = 14 - 2.85387
pOH = 11.1461
pOH = 11.1461
La concentración de OH- se calcula con la fórmula;
[OH-] = 10-pOH
[OH-] = 10-11.1461
[OH-] = 7.1428 x 10-12M
[OH-] = 7.1428 x 10-12M


No hay comentarios.
SI DESEAS AYUDA Y HACES UN COMENTARIO ANONIMO, DEJANOS UN DATO PARA PODER CONTACTARTE Y PODER APOYARTE