
RESOLVIENDO LOS NÚMEROS CUÁNTICOS
Antes que nada, si lo que deseas es saber cómo calcular los números
cuánticos, aquí te tengo un tutorial para calcular números cuánticos donde te explico paso a paso como hacerlo.
Cada ejercicio lo hare usando ejemplos de los bloques S, P, D, F, empecemos;
Calculo normal de los números cuánticos.
Calcular los números cuánticos del Calcio;
Calcio, es un ejemplo para el bloque "S", Lo puedes observar desde su
configuración electrónica, debido a que la última capa termina en "S",
entonces "l=0".
Calcular los números cuánticos del Zinc;
Observe cómo "m" crece a medida que la capacidad de electrones de la
última capa también lo hace, a diferencia del calcio, la ultima capa
terminaba en "s" su capacidad es de 2 electrones, mientras en éste ejemplo
la última capa termina en "d", su capacidad es de 10
electrones.
También enumeré cada flecha (electrones), es el orden correcto de
colocarlos.
Calcular los números cuánticos del Cloro;
Para esta situación, la última capa termina en "p" ,su capacidad de
electrones es de 6, sin embargo, solo es necesario acomodar 5 electrones,
pues, el exponente en la configuración electronica es de 5.
Calcular los números cuánticos del Uranio;
Para el uranio, la última capa termina en "f", la capacidad es de 14
electrones, pero solo se requieren 4 para acomodarla en el orden ya
explicado.
Sin embargo el Uranio es un elemento que presenta anomalía en su
configuración electrónica, El último renglón de elementos corresponde a la serie de los actínidos,
que comienza con el torio (Z = 90). Muy pocos de estos elementos se
encuentran en la naturaleza; la mayor parte se ha sintetizado.
Con algunas excepciones, es factible escribir la configuración
electrónica de cualquier elemento empleando como guía el (Orden en el
cual se llenan los subniveles atómicos en un átomo polielectrónico.
Comienza con el orbital 1s y desciende en dirección de las flechas.
Así, el orden es como sigue: 1s < 2s < 2p < 3s < 3p <
4s < 3d < . . .).
Con los elementos que se debe tener más cuidado es con los
metales de transición, los lantánidos y los actínidos.
Como se señaló antes, para valores grandes del número cuántico
principal n, el orden de llenado de un subnivel en un elemento puede
cambiar para el siguiente elemento. En los datos que se encuentra
AQUÍ se agrupan los elementos según el tipo de subnivel que ocupan
los electrones más externos.
Por lo tanto la configuración electrónica el Uranio, se extiende a la
siguiente configuración;
U (Z = 92) : 【 Rn 】7s2 5f3 6d1
Puedes usar el siguiente Simulador para calcular los números cuánticos, para comprobar tus operaciones.
Los Números cuánticos Aquí calculados, están basados en las
configuraciones electrónicas de elementos en su estado fundamental. cada
átomo puede comportarse de otra forma, tal que electrones de la sub-capa
"S" salten a la última capa, estos temas lo encontrarás como Regla de
Hund y principios de de exclusión de Pauli.





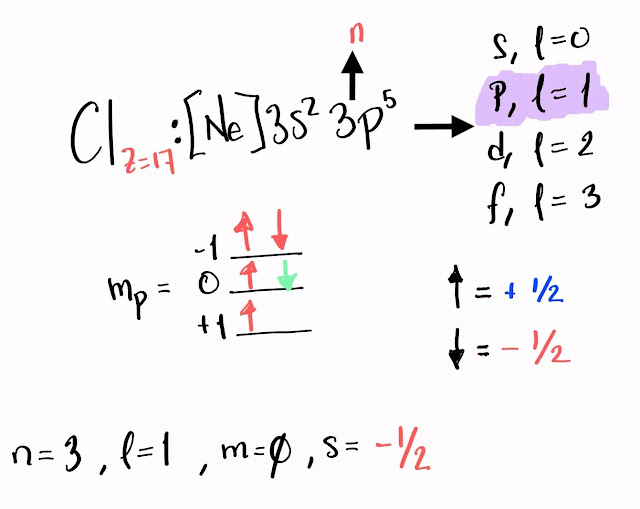

Hola solo escribo para comentar que el numero cuántico ml del zinc esta mal seria (3, 2, 2,-1/2)��
ResponderBorrarEste comentario ha sido eliminado por el autor.
BorrarCorregido
BorrarHolaa, alguien me podria dar los numeros cuanticos del silicio?
ResponderBorrarclaro , es: n =3, l=1, m= 0, s = +1/2
BorrarDiga cuál es el error que hay en cada uno de los conjuntos de números cuánticos
ResponderBorrara. 2, 3, 0, +1/2
b. 3, 0, 1, +1/2
c. 0, 1, 1, +1/2
d. 3. 0, 2, -1/2
Ayuda
Hola, claro que sí, en :
Borrara: para l = 3 no puede haber n = 2 , ya que pa ra l = 3 solo puede haber mínimo n = 4
b: si l = 0 entonces m = 0 pues hablamos d ella subcapa "s" y en "s" m = 0 siempre
c: n nunca puede vale cero
d: si l = 0 entonces m = 0 siempre, ahi marca que m = 2 y eso es incorrecto
Numeros cuanticos del vanadio y del kripton por favor
ResponderBorrarDel Vanadio: |n = 3 l = 2 m = 0 s = 1/2| del Kriptón: |n = 4 l =1 m = -1 s = -1/2|
BorrarEste comentario ha sido eliminado por el autor.
ResponderBorrar(2.0+1.-1/2)
ResponderBorrarSi tiene dudas , arriba tenemos un botón donde atendemos a los estudiantes con dudas
BorrarMarca la combinación correcta.
ResponderBorrara)2,0,+1,-1/2
b)3,1,+2,+1/2
c)1,1,0,-1/2
d)2,1,+1,+1/2
e)0,1,0,+1/2
INCISO D, SE TRATA DEL BORO
Borraren el Zn el n debería ser 4 ya que siempre se toma el mayor numero en la config electrónica
ResponderBorrarEstas en lo incorrecto ya que "n" hace referencia al periodo o nivel de elemento, y el zinc se encuentra en el periodo y el ultimo electrón esta en el nivel 3d, saludos
Borrarindica qué número cuántico es correcto A. (4;4;3;1/2) B. (4:3;-2;+1/2) C. (3;2;3; +1/2) D. (3:2;2; -1/3) E. (4:5;3;+1/2)
ResponderBorrarLA A ES INCORRECTA
BorrarLA C ES INCORRECTA
LA D ES INCORRECTA
LA E ES INCORRECTA
LA B ES LA CORRECTA
LA A ES INCORRECTA
ResponderBorrarLA C ES INCORRECTA
LA D ES INCORRECTA
LA E ES INCORRECTA
LA B ES LA CORRECTA
¿Cuáles son los números cuánticos del cobre?
ResponderBorrarcual es la configuracion electronica de el torio
ResponderBorrarLO HARE Y LA PUBLICO PERO DEBEN DEJAR SUS DATOS PARA AVISARLES
BorrarNúmeros cuánticos del cromo, por favor
ResponderBorrar