Resuelvo reacción Química por REDOX
Resolver esta reacción química por el método REDOX no es tan fácil como se
muestra la reacción química, del 1 al 10, yo le pondría un 8 de
dificultad. Aquí te muestro el proceso que usé para resolverlo.
Video tutorial
Procedimiento
Paso 1. Comprobar si la reacción esta balanceada, identificar qué
elementos están en la misma proporción e identificarlos (ayudará de mucho
mas tarde).
2 - I - 1
1 - H - 2
1 - N - 1
3 - O - 5
NO BALANCEADA
Paso 2. Colocar el número de oxidación a cada elemento
*¿No sabes cómo se coloca cada número de oxidación?
▷ IDENTIFICAR ✅ EL NÚMERO DE OXIDACIÓN EN UN COMPUESTO TRUCO
❤️
Paso 3. Identificar y separa los elementos que se reducen
y se oxidan respectivamente, colocar cuantos electrones de diferencia
hay entre cada uno de ellos.
Para éste caso se uso un balance de la mini reacción, esto sucede con
el yodo, ya que se tiene en proporciones diferentes en la reacción
química:
Paso 4. Realiza un balance de electrones, toma en cuenta que sumar electrones restan los números de
oxidación;
Paso 5. Cruzar los coeficientes que tienen los electrones
a la otra fila;
Paso 6. Multiplica el coeficiente por toda la fila, cada
coeficiente se multiplica por su fila, de tal manera que obtengas
una sola fila, tanto reactivos como productos;
Podrás observar que que los electrones se anulan por ser semejantes
3I2 + 10HNO3 → 6HIO3 + 10NO + H2O
Observa que cada elemento tiene su número de oxidación, el
coeficiente se habrá de colocar al compuesto que tenga precisamente
ése elemento.
Verificamos si la reacción está balanceada;
6 - I -
6
10 - N - 10
10 - H - 8
30 - O - 29
NO BALANCEADA
Paso 7. Si la reacción no queda balanceada, hacer las modificaciones
tanteando y considerando los siguientes puntos;
Balancear primero los no metales, los metales, hidrógeno y por
último al oxígeno.
Colocamos un 2 a la molécula del agua para tener los números de
Oxígeno en números pares, enseguida ajustamos los números de
Hidrógenos colocando un 10 al ácido nítrico:
3I2 + 10HNO3 → 6HIO3 + 10NO + 2H2O



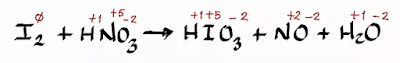





No hay comentarios.
SI DESEAS AYUDA Y HACES UN COMENTARIO ANONIMO, DEJANOS UN DATO PARA PODER CONTACTARTE Y PODER APOYARTE