![▷ PbO2 + Pb + H2SO4 → PbSO4 + H2O [ REDOX solución ] ▷ PbO2 + Pb + H2SO4 → PbSO4 + H2O [ REDOX solución ]](https://blogger.googleusercontent.com/img/a/AVvXsEgoJGDdOyOKl0gJfbajRlJXRc9Ef3E34PJs-sm_ye6ZwDFDrFPWtrzXIFO5maphsMLsxEncq8ALVJb32GN6jlxV3Cb-cA3XSRdAm2BlWNWcgNqSxOMo8KU9mYPJk5-r9rHtlUDVq4v7YOSmY5KE_LsqcgaqzJ7WKGvpu8k0-fAYF2icREMCn5m58CM_Fg=w600)
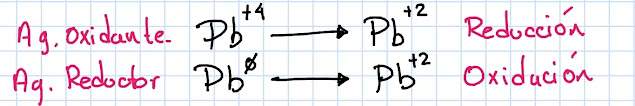
¿El Pb es el agente reductor y el agente oxidante?
Algo interesante de balancear esta reacción química por el método redox fue
que el agente reductor y oxidante es el plomo, pero estos fueron los plomos
con valencias distintas. Es interesante por que el Oxido de plomo, como su
nombre lo dice es plomo oxidado y el plomo en su estado natural no son lo
mismo, y en el balance se ocupan la misma cantidad de moles, ¿Qué pasaría si
no se tiene plomo oxidado?, bueno esa es otra historia, te dejo el proceso
de solución aquí.
Ver video clase
Reacción química
PbO2 + Pb + H2SO4 → PbSO4
+ H2O
Colocando las valencias a cada elemento químico
Identificando qué elemento se oxida y cual se reduce, y con ello quien es el agente reductor y quien es el agente oxidan (quien se oxida es el agente reductor y quien se reduce es el agente oxidante)
Balance de la ecuación parcial e identificando quien gana o pierde electrones (quien se reduce gana electrones, quien se oxida pierde electrones)
Multiplicación de los factores con la ecuación parcial (los coeficientes se cruzan)
Elaborando la semi-reacción (los factores se multiplican por la ecuación parcial balanceada)
Colocando los coeficientes en los respectivos elementos y observar si la reacción queda balanceada, en caso contrario balancearla
2PbO2 +
2Pb + H2SO4 →
2PbSO4 +
H2O
4 - Pb - 2
8 - O - 9
2 - H - 2
1 - S - 2
No balanceada
Ajustar la reacción química (orden del ajuste: Pb, S, H, O)
2PbO2 + 2Pb + H2SO4 → 4PbSO4 + H2O
4 - Pb - 4
8 - O - 17
2 - H - 2
1 - S - 4
No balanceada
2PbO2 + 2Pb +
4H2SO4 →
4PbSO4 +
H2O
4 - Pb - 4
20 - O - 17
8 - H - 2
4 - S - 4
No balanceada
2PbO2 + 2Pb + 4H2SO4 → 4PbSO4 +
4H2O
4 - Pb - 4
20 - O - 20
8 - H - 8
4 - S - 4
Balanceada







No hay comentarios.
SI DESEAS AYUDA Y HACES UN COMENTARIO ANONIMO, DEJANOS UN DATO PARA PODER CONTACTARTE Y PODER APOYARTE