
Balance de electrones
El balance de electrones es como llevar la cuenta de los pases en un partido. En una reacción química, todos los electrones tienen que estar "contabilizados". Ningún electrón puede simplemente desaparecer o aparecer de la nada.
Ver otras Clases REDOX
¿Por qué es importante el balance de electrones?
Equilibrar la ecuación: Para que una ecuación química sea correcta, el número de átomos de cada elemento debe ser el mismo en ambos lados de la flecha. El balance de electrones nos ayuda a asegurarnos de que esto suceda.
Identificar la oxidación y la reducción: Cuando un átomo pierde electrones, se oxida. Cuando gana electrones, se reduce. Al balancear los electrones, podemos identificar qué átomos se están oxidando y cuáles se están reduciendo.
Un ejemplo es este video (Balance de electrones)
¿Cómo se cuentan los electrones de un elemento?
En química hemos visto que el número atómico es igual al numero de
protones y el número de protones es igual al numero de electrones, por
tanto, el número atómico será igual al numero de electrones que tiene un
elemento.
¿Cuándo se trata de ceder o dar electrones?
los átomos ceden o dan electrones para llegar a un equilibro en su
estructura química, por ejemplo:
Pueden observar que el Na tiene un signo + y el Cl un signo -, estos
signos tienen un por que, se definen de la siguiente forma:
Cuanto tiene un signo +, significa que cedieron electrones, si el signo
esta acompañado de un numero, por ejemplo 2+, significa que cedieron 2
electrones, es decir, si el átomo en total tiene 18 electrones y tiene
un 2+, quiere decir que ha cedido 2 electrones y ahora tiene 16 en
total.
Caso contrario, si tiene el signo -, significa que ha aceptado
electrones, es decir, si el átomo tienen un total de 21 electrones y
tiene 1-, quiere decir que ha aceptado 1 electrón y ahora tiene 22
electrones en total.
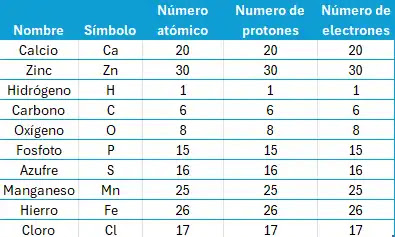
¿Cuántos electrones tiene un átomo en su estado natural?
Como puedes observar, el Número atómico de cada elemento nos indica el
número de electrones de cada elemento en su estado natural o
equilibrio
¿Cómo se mueven los electrones en una reacción química o compuesto químico?
En una reacción química los átomos ceden o aceptan electrones, para
poder
identificarlos es necesario colocar el número de oxidación
a cada elemento en el compuesto químico, veamos un ejemplo:
Reacción 1: I0→I+5 (Oxidación del Yodo)
Conoce el número atómico:
El yodo (I) tiene un número atómico de 53. Esto significa que un átomo de
yodo siempre tendrá 53 protones en su núcleo.
Estado inicial (I0):
En su estado neutro (I0), el átomo de yodo tiene 53 protones (carga +53) y, para mantener la
neutralidad, también tiene 53 electrones (carga -53). La suma de las
cargas es:
53 (protones)−53 (electrones)=0.
Estado final (I+5):
El yodo ahora tiene un estado de oxidación de +5. Sus 53 protones siguen
en el núcleo. Para que la carga neta del átomo sea +5, debe haber perdido
electrones.
Calculamos los electrones restantes:
53 (protones) + electrones =+5.
electrones=+5−53=−48.
electrones=+5−53=−48.
Esto significa que el átomo de I+5 tiene 48 electrones.
Balance de electrones:
- Inicialmente, el yodo tenía 53 electrones.
- Finalmente, tiene 48 electrones.
- La diferencia es 53−48=5 electrones.
- Como el número de electrones disminuyó (de 53 a 48), el yodo perdió 5 electrones.
- I0→I+5+5e- (El yodo liberó 5 de sus electrones).
Reacción 2: N+5→N+2 (Reducción del
Nitrógeno)
Conoce el número atómico: El nitrógeno (N) tiene un número atómico de 7. Esto significa que un átomo de nitrógeno siempre tendrá 7 protones en su núcleo.
Estado inicial (N+5):
En este estado, el nitrógeno tiene 7 protones (carga +7). Su carga neta es +5.Calculamos los electrones presentes: 7 (protones)+electrones=+5.
electrones=+5−7=−2.
Esto significa que el átomo de N+5 tiene 2 electrones.
Estado final (N+2):
El nitrógeno ahora tiene un estado de oxidación de +2. Sus 7 protones siguen en el núcleo.Calculamos los electrones restantes: 7 (protones)+electrones=+2.
electrones=+2−7=−5.
Esto significa que el átomo de N+2 tiene 5 electrones.
Balance de electrones:
- Inicialmente, el nitrógeno tenía 2 electrones.
- Finalmente, tiene 5 electrones.
- La diferencia es 5−2=3 electrones.
- Como el número de electrones aumentó (de 2 a 5), el nitrógeno ganó 3 electrones.
- N+5+3e-→ N+2 (El nitrógeno aceptó 3 electrones).
El tema es confuso, pues cuando el numero de oxidación es +, debemos usar la cantidad de electrones en el estado neutro del elemento y restarle el coeficiente del número de oxidación, y si tiene - debemos sumar.
Te invito a ver ejercicios resueltos de balance de electrones que tenemos en el botón de abajo
Balance de electrones quedaría
I0 → I+5 + 5e-
3e- + N+5 → N+2




No hay comentarios.
SI DESEAS AYUDA Y HACES UN COMENTARIO ANONIMO, DEJANOS UN DATO PARA PODER CONTACTARTE Y PODER APOYARTE