
Guía Definitiva para Colocar Números de Oxidación en el Balance por Método Redox
En el mundo de la química, el balanceo de ecuaciones por el método redox es
esencial para entender y predecir reacciones químicas.
Una parte crucial de este proceso es asignar números de oxidación a
los elementos químicos involucrados. En este artículo, exploraremos paso a
paso cómo realizar esta tarea de manera efectiva.
Video clases
VER OTRAS CLASES REDOX
¿Qué son los números de oxidación?
Antes de sumergirnos en el balance por el método redox, es fundamental
comprender qué son los números de oxidación. Estos números representan la
carga real o aparente de un átomo en un compuesto o una molécula.
Se utilizan para determinar qué átomos están ganando o perdiendo
electrones durante una reacción química.
Pasos para colocar los números de oxidación
Paso 1: Identificar los elementos presentes en la ecuación
El primer paso para asignar números de oxidación es identificar los
elementos presentes en la ecuación química. Por ejemplo, consideremos la
siguiente reacción:
H₂ + O₂ → H₂O
Aquí, los elementos son el hidrógeno (H) y el oxígeno (O).
Paso 2: Conocer las reglas para asignar números de oxidación
Existen reglas específicas para asignar números de oxidación a los elementos
en una molécula o un compuesto. Algunas de estas reglas incluyen:
El número de oxidación de un elemento libre en su estado estándar es
igual a cero.
El
número de oxidación de un ion monoatómico es igual a la carga del ion.
En compuestos binarios,
el
número de oxidación del elemento más electronegativo es negativo,
mientras que el del elemento menos electronegativo es positivo.
En moléculas o poliatómicos, el número de oxidación de un elemento
se calcula asumiendo que los enlaces son iónicos.
Paso 3: Aplicar las reglas a la ecuación química
Ahora, aplicaremos estas reglas a nuestra ecuación original:En H₂, el
hidrógeno tiene un número de oxidación de 0 porque está en su estado
elemental.
En O₂, el oxígeno también tiene un número de oxidación de 0.
En H₂O, el hidrógeno tiene un número de oxidación de +1, mientras que el
oxígeno tiene un número de oxidación de -2.
Conclusión
Al seguir estos pasos, puedes asignar números de oxidación a los elementos
químicos en una ecuación y, por lo tanto, balancearla por el método redox.
Este proceso es fundamental para comprender y predecir reacciones químicas
en diversos contextos.
¡No dudes en dejarnos tus comentarios o preguntas!



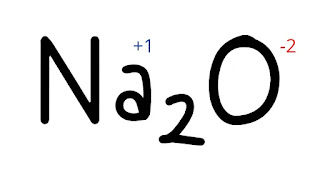
No hay comentarios.
SI DESEAS AYUDA Y HACES UN COMENTARIO ANONIMO, DEJANOS UN DATO PARA PODER CONTACTARTE Y PODER APOYARTE