![▷ K2Cr2O7 + FeCl2 + HCl → CrCl3 + KCl + FeCl3 + H2O [ SOLUCIÓN por REDOX ] ▷ K2Cr2O7 + FeCl2 + HCl → CrCl3 + KCl + FeCl3 + H2O [ SOLUCIÓN por REDOX ]](https://blogger.googleusercontent.com/img/a/AVvXsEjqsOOYMAPWacGBpjzKGkidzTMcB0GGojKMZ7TQwVf3oF64NL5cvOf1p4BeNkn-PR5Kh525Ecn_0ra-eOk0iEX2yKjn8UfPV_HDKjYQ4q6P-H52yC80M7WI-MnXRG0JSNS1JQR5YQLqh0IBYd0VpA7cfqD0G7WnT1ES5CS3sIWxRfw9e1tc3YY_2Dx7aQ=w600)
Usando fracciones en el balance REDOX
La solución de este ejercicio es difícil, pues al hacer el ajuste fue necesario el uso de fracciones el cual, un alumno promedio de secundaria le costaría o dudaría a usarla. Te invito a ver como lo he resuelto y mires la forma correcta de implementar las fracciones en el balance de reacciones químicas por el método redox.
Video tutorial Balance REDOX
Reacción química
K2Cr2O7 + FeCl2 + HCl → CrCl3 + KCl + FeCl3 + H2O
Estados de Oxidación
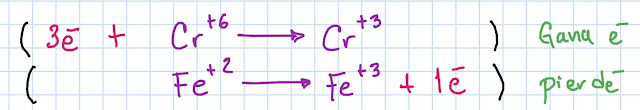
La ecuación parcial de los elementos que se oxidan y se reducen
Balance de electrones de la ecuación parcial
Cruce de coeficientes
La semi-reacción
Sustitución de coeficientes en la reacción original
1K2Cr2O7 + 3FeCl2 + HCl → 1CrCl3 + KCl + 3FeCl3 + H2O
Último ajuste de la reacción
(1)K2Cr2O7 + 3FeCl2 + 7HCl → 1CrCl3 + KCl + 3FeCl3 + H2O
(1/2)K2Cr2O7 + 3FeCl2 + 7HCl → 1CrCl3 + KCl + 3FeCl3 + H2O
(1/2)K2Cr2O7 + 3FeCl2 + 7HCl → 1CrCl3 + KCl + 3FeCl3 + (7/2)H2O
Comprobación
(1/2)K2Cr2O7 + 3FeCl2 + 7HCl → 1CrCl3 + KCl + 3FeCl3 + (7/2)H2O
1 - K - 1
1 - Cr - 1
3.5 - O - 3.5
3 - Fe - 3
13 - Cl - 13
7 - H - 7
Balanceada







Como puedo sacar los moles iniciales y los moles que reaccionan de esa reaccion quimica, saludos .
ResponderBorrarLOS MOLES QUE REACCIONAN SON LOS COEFICIENTES ESTEQUIOMETRICOS DE LA REACCION BALANCEADA,
BorrarPuedes balancear esto K2Cr2O7 + HCl + FeCl2 → KCl +CrCl3 + FeCl3+ + H2O
ResponderBorrar