![▷ Balance por REDOX NaCl + MnO2 + H2SO4 = Cl2 + MnSO4 + Na2SO4 + H2O ✅ [SOLUCIÓN] ▷ Balance por REDOX NaCl + MnO2 + H2SO4 = Cl2 + MnSO4 + Na2SO4 + H2O ✅ [SOLUCIÓN]](https://blogger.googleusercontent.com/img/a/AVvXsEhtwv1pHAFQJ5LHLw_vqAk23yNvssz7fVlKKQwJ-6sfOAB8IBWxUJxTXSH_o8FqGYOXKbXm1Ul3eb5Hikoq0fP8BKdkKBD9jaI6XxeOQ-l5y00RJtLLO-TXbrMI51gg8kPlA1Yg6TaTWuWb5qCOrHx3UhonPThTACYKWdw0PPEkfMAP9SMVMg8dpJbHBQ=w600)
Aprende a balancear por REDOX
Te explicaré cómo balancear por el metodo de Óxido Reducción la siguiente
reacción Química;
NaCl + MnO2 + H2SO4 → Cl2 + MnSO4 + Na2SO4 + H2O
¿Quieres ver la solución por el método algebraico?
Miralo aquí; ▷ BALANCEANDO NACL + MNO2 + H2SO4 >>> CL2 + MNSO4 + NA2SO4 + H2O ✅ M. ALGEBRAICO
Ver video tutorial
NaCl + MnO2 + H2SO4 → Cl2 + MnSO4 + Na2SO4 + H2O
1- Na -2
1- Cl -2
1- Mn -1
1- S -2
2- H -2
6- O -9
La reacción NO esta balanceada
Los coeficientes de los elementos marcados con amarillo nos pueden ayudar, pues éstos no deben cambiar, es decir; Si en algún momento toca poner coeficiente 3 al MnO2, debemos poner coeficiente 3 al MnSO4
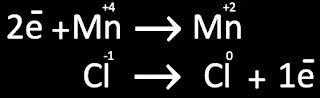
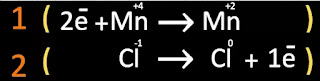
Paso 2. Colocar el número de oxidación a cada elemento.
Paso 3. Identificar y separa los elementos que se reducen y se oxidan respectivamente, colocar cuantos electrones de diferencia hay entre cada uno de ellos.
Paso 4. El balance de electrones. Aquí notarás que los electrones que suman en realidad restan, ¿Quieres saber por qué?
Paso 6. Semireacción. Multiplicamos los coeficientes por la ecuación parcial que generó el balance de electrones;
Paso 7. Sustitución de resultados. Colocamos los coeficientes en los compuestos que le correspondan a los elementos de la semireacción;
2NaCl + 1MnO2 + H2SO4 → 2Cl2 + 1MnSO4 + Na2SO4 + H2O
Como pueden observar el Cloro no esta balanceado, eliminamos el coeficiente 2, de la molecular Cloro (Cl2);
2NaCl + 1MnO2 + H2SO4 → Cl2 + 1MnSO4 + Na2SO4 + H2O
LA REACCIÓN AUN NO ESTÁ BALANCEADA
Paso 8. Balancear en el siguiente orden si es posible;
Primero balanceamos cualquier elemento (que no sea hidrógeno u oxígeno) Después balanceamos al
hidrogeno Por último balanceamos al Oxígeno.
Siguiendo lo que nos dice el paso 8, tocará balancear al Azufre (S), colocamos un 2 al compuesto (H2SO4 );
2NaCl + 1MnO2 + 2H2SO4 → Cl2 + 1MnSO4 + Na2SO4 + H2O
2- Na -2
2- Cl -2
1- Mn -1
2- S -2
4- H -2
10- O -9
La reacción NO esta balanceada
2NaCl + 1MnO2 + 2H2SO4 → Cl2 + 1MnSO4 + Na2SO4 + 2H2O
2- Na -2
2- Cl -2
1- Mn -1
2- S -2
4- H -4
10- O -10
BALANCEADA






Este blog ha sido eliminado por un administrador de blog.
ResponderBorrar