.webp)
¿NO entiendes el método REDOX?, Eso se termino con esta explicación
Paso 1. Comprobar si la reacción esta balanceada,
identificar qué elementos están en la misma proporción e identificarlos
(ayudará de mucho mas tarde).
Video tutorial
K2Cr207 + HCl → KCl + CrCl3 + H2O + Cl2
2 - K - 1
2 - Cr - 1
7 - O - 1
1 - H - 2
1 - Cl - 6
NO BALANCEADA
Paso 2. Colocar el número de oxidación a cada
elemento
*¿No sabes cómo se coloca cada número de oxidación?
▷ IDENTIFICAR ✅ EL NÚMERO DE OXIDACIÓN EN UN COMPUESTO TRUCO ❤️
Paso 3. Identificar y separa los elementos que se
reducen y se oxidan respectivamente, colocar cuantos electrones
de diferencia hay entre cada uno de ellos. Notese que se ha balanceado el cloro, esto sucede generalmente con los elementos gaseosos.
Paso 4. Realiza un balance de electrones, toma en cuenta que sumar electrones restan los números de
oxidación;
Paso 5. Cruzar los coeficientes que tienen los
electrones a la otra fila;
Paso 6. Multiplica el coeficiente por toda la
fila, cada coeficiente se multiplica por su fila, de tal
manera que obtengas una sola fila, tanto reactivos como
productos;
Podrás observar que que los electrones se anulan por ser
semejantes
1K2Cr207 + 6HCl → KCl + 1CrCl3 + H2O + 3Cl2
Observa que cada elemento tiene su número de oxidación, el
coeficiente se habrá de colocar al compuesto que tenga
precisamente ése elemento;
1K2Cr207 + 6HCl → KCl + 1CrCl3 + H2O + 3Cl2
2 - K - 1
2 - Cr - 1
7 - O - 1
6 - H - 2
6 - Cl - 10
NO BALANCEADA
- Primero balanceamos el metal después el no metal
- Después balanceamos al hidrogeno
- Por último balanceamos al Oxígeno
Entonces; Toca ajustar al potasio (K) y al cromo (Cr) colocando
el coeficiente "2" para ajustar cada uno;
1K2Cr207 + 6HCl → 2KCl + 2CrCl3 + H2O + 3Cl2
2 - K - 2
2 - Cr - 2
7 - O - 1
3 - H - 2
3 - Cl - 14
NO BALANCEADA
Según las consideraciones del paso 7, ahora toca ajustar al
cloro (Cl), Cambiando el coeficiente "3" del HCl y ajustando con
el coeficiente "14", enseguida colocamos el coeficiente "7"
al H2O;
1K2Cr207 + 14HCl → 2KCl + 2CrCl3 + H2O + 3Cl2
2 - K - 2
2 - Cr - 2
7 - O - 7
14 - H - 14
14 - Cl - 14
BALANCEADA
✅ Twitter
_


.webp)


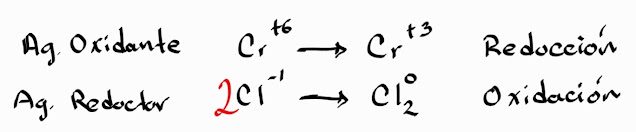

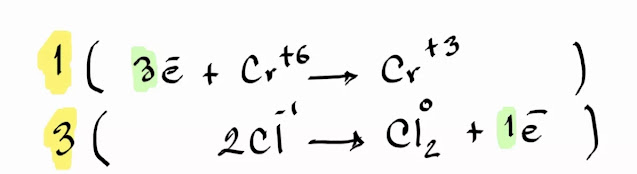

cada vez me vacila más esta página
ResponderBorrarLamentamos su experiencia, esta pagina es artesanal, lo realizamos como hobby pero el objetivo siempre es ayudar a otros, si tienes algun problema siempre respondemos a los comentarios, de momento este post se actualizo al 100%
Borrarel numero de oxidación de potasio es de +1, no es de +2 (como lo muestran en el ejercicio)
ResponderBorrarCorregido ! Grcias por tu comentario
Borrar