
Despídete de las fracciones en química
Con el balance de esta reacción les enseñaré un ¡trucazo! que usamos para
no dar tanta vuelta en el ajuste por tanteo último del proceso del balance
REDOX.
Reacción química a balancear por REDOX
HNO2 + KI + HCl → I2 + N2 + KCl +
H2O
Colocando el estado de oxidación de cada cada componente
¿Quieres aprender a colocar números de oxidación?
Video tutorial del balance por el método REDOX
En el siguiente video podrás observar cómo le doy solución al balance
por el método redox de esta reacción química
Identificar el cambio de valencia
Quién se oxida y quien se reduce
Recuerda identificar el que se reduce primero, pues la propia palabra
da un significado y fácil de entender
Agente reductor y agente oxidante
Para este caso existe un balance de esta mini reacción, puedes
observar que los elementos se encuentran en cantidades diferentes, es
por ello que se realiza un balance sencillo previo a continuar:
Balance de electrones
¿Por qué sumar electrones en realidad se restan?
La semi - reacción
Para la semi reacción los coeficientes resultados del balance de
electrones se cruzan, quedando de la siguiente manera;
Balance parcial
2HNO2 + 6KI + HCl →
3I2 +
N2 + KCl + H2O
2 - H - 2
1 - N - 2
2 - O - 1
3 - K - 1
3 - I - 6
1 - Cl - 1
NO BALANCEADA
Ajuste del balance
Para éste caso tomaremos en cuenta los elementos en su estado natural y
decidiremos ajustarlos al ultimo para tratar de ajustar primero al
oxígeno;
Resumen de movimientos
2HNO2 + 6KI + HCl
→ 3I2 +
N2 + KCl + H2O
Ajustamos la cantidad de potasio (K) colocando un 6 al KCl, al mismo
tiempo ajustamos el cloro en los reactivos colocando también un 6
al HCl
2HNO2 + 6KI
+ 6HCl → 3I2 +
N2 + 6KCl +
H2O
Ajustamos la cantidad de hidrógenos colocando un 4 a H2O y el oxigeno queda balanceado.
2HNO2 + 6KI
+ 6HCl → 3I2 +
N2 + 6KCl +
4H2O
Respuesta;
2HNO2 + 6KI + 6HCl → 3I2 + 1N2 + 6KCl + 4H2O
8'8 - H - 8
2 - N - 2
4 - O - 4
6 - K - 6
6 - I - 6
6 - Cl - 6
BALANCEADA




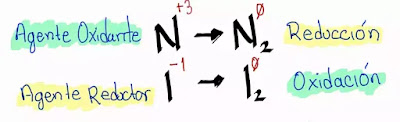



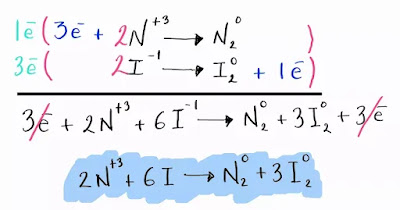
No hay comentarios.
SI DESEAS AYUDA Y HACES UN COMENTARIO ANONIMO, DEJANOS UN DATO PARA PODER CONTACTARTE Y PODER APOYARTE