
Un balanceo Redox Super Fácil
Balancear la siguiente reacción es interesante, pues en este caso tenemos
un peróxido y bien se sabe que la valencia del peróxido es -1 y no -2 esto
hace que en la semireacción suceda algo interesante, pero nada que no
podamos resolver.
Reacción química
PbS + H2O2 → PbSO4 + H2O
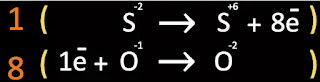
Paso 1. Estados de Oxidación
Paso 2. Identificar quién se reduce y quien se oxida, así también como el
agente reductor y oxidante
Paso 3. Hacer el balance de electrones
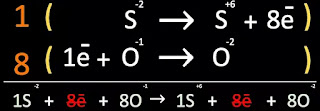
Paso 4. Cruzar los coeficientes obtenidos del balance de electrones
Paso 5. Obtener la semireacción multiplicando los coeficientes por las
reacción parcial que le correspondan
Paso 6. Sustituir los coeficientes obtenidos de la semireacción en la
reacción original y comprobar si la reacción está balanceada
1PbS + 8H2O2 → 1PbSO4 + 8H2O
1 -- Pb -- 1
1 -- S -- 1
16 -- H -- 16
16 -- O -- 12
NO BALANCEADA
Paso 7. Ajustar la reacción si es necesario.
Para ajustar el oxigeno, colocamos un 2 al PbSO4
1PbS + 8H2O2 → 2PbSO4 + 8H2O
1 -- Pb -- 2
1 -- S -- 2
16 -- H -- 16
16 -- O -- 16
NO BALANCEADA
Ajustamos el Pb y el S colocando un coeficiente 2 al PbS
2PbS + 8H2O2 → 2PbSO4 + 8H2O
2 -- Pb -- 2
2 -- S -- 2
16 -- H -- 16
16 -- O -- 16
BALANCEADA






No hay comentarios.
SI DESEAS AYUDA Y HACES UN COMENTARIO ANONIMO, DEJANOS UN DATO PARA PODER CONTACTARTE Y PODER APOYARTE