
Relación presión - volumen : Ley de Boyle
Robert Boyle en el siglo XVII estudio sistemática y cuantitativamente el
comportamiento de los gases.
Boyle investigó la relación presión - volumen de una muestra gaseosa
usando un aparato como el que se muestra a continuación;
En la imagen anterior hay un incremento de presión debido a la adición de
mercurio y resulta un desnivel en las dos columnas; en consecuencia, el
volumen del gas disminuye.
Boyle notó que cuando la temperatura se mantiene constante, el volumen
(V) de una cantidad dada de gas disminuye cuando la presión total aplicada
(P)
-La presión atmosférica más la presión debida a la adición de
mercurio-
aumenta. Esta relación lo puedes observar en la imagen de arriba el b), c) y d),
inversamente si la presión aplicada disminuye, el volumen del gas aumenta,
observe la siguiente tabla:
Los datos P-V registrados realmente para el experimento son congruentes con estas expresiones matemáticas que muestra la relación inversa:
V es proporcional a 1/P
También se puede expresar de la siguiente manera:
V = K1 x (1/P)
Donde el símbolo K1 es una constante llamada, constante de proporcionalidad,
la expresión anterior es de la ley de Boyle que establece que el volumen
de una cantidad fija de un gas mantenido a temperatura constante es
inversamente proporcional a la presión del gas, y de la ecuación anterior, se obtiene:
PV = K1
La ecuación anterior es otra forma de la Ley de Boyle qu edice que el
producto de la presión por el volumen d eun gas es constante a temperatura
constante.
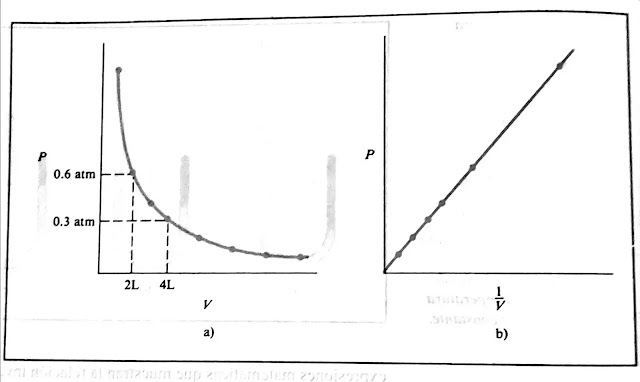
La imagen de arriba muestra dos gráficas para expresar los
descubrimientos de Boyle. La
a) es una gráfica de la ecuación PV = K1, la
b) es una gráfica de la ecuación equivalente, P = K1 x (1/V), Note en las graficas que esta ecuación toma la
forma de una ecuación lineal y = mx + b, donde b = 0.
A pesar de que los valores por si solos de presión y temperatura pueden
variar grandemente para una muestra dada de gas, mientras la temperatura
permanezca constante y la cantidad de gas no cambie,
P multiplicada por V es siempre igual a la misma constante. En
consecuencia, para una misma muestra de gas en dos conjuntos diferentes de
condiciones, se puede escribir:
P1V1 = K1 = P2V2
ó
P1V1 = P2V2
Donde V1 y V2 son los volúmenes a las presiones P1 y P2 respectivamente.
Las aplicaciones de esta ecuación de puede usar para predecir como se
verá afectado el volumen de un gas por el cambio de presión, o cómo la
presión ejercida por un gas será afectada por el cambio de
volumen.

|
| Cuando un buzo entra al mar y sale sus pulmones tienen efectos relacionadas con el principio de la ley de boyle y es importante conocer estos conceptos |





No hay comentarios.
SI DESEAS AYUDA Y HACES UN COMENTARIO ANONIMO, DEJANOS UN DATO PARA PODER CONTACTARTE Y PODER APOYARTE