
Ley de Boyle vs Ley de Charles y Gay Lussac
Para aplicar la ley de Boyle la temperatura del sistema permanece constante. Pero suponga que la temperatura varia. ¿Cómo afecta el cambio de temperatura el volumen y la presión de un gas?. Los pioneros en realizar investigaciones para esta relación fueron los científicos franceses, Jacques Charles y Josep Gay Lussac. Estos estudios mostraron que a presión constante el volumen de una muestra se expande cuando se calienta y se contrae cuando se enfría.
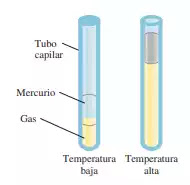 |
| Variación del volumen de una muestra de un gas con la temperatura, a presión constante. La presión ejercida sobre el gas es la suma de la presión atmosférica y la presión debida al peso del mercurio. |
Esta conclusión puede ser evidente en sí y éstas relaciones en los cambios de temperatura y volumen resultan ser congruentes. A cualquier presión, la relación de volumen - temperatura en una gráfica es una línea recta. Extrapolando la recta a volumen cero, se encuentra que la intersección con el eje de la temperatura es -273.15 °C. A cualquier presión se obtiene otra línea recta para la relación volumen - temperatura pero se llega a la misma intersección a -273.15 °C. (en la vida real se puede medir el volumen de un gas sólo sobre cierto límite de temperatura, por que todos los gases se condensan a bajas temperaturas para formar líquidos).
El cero absoluto
En 1848 Lord Kelvin entendió el significado de este comportamiento, identificó la temperatura ya mencionada -273.15 °C como teóricamente la menor temperatura alcanzable, llamándola cero absoluto. Con el cero absoluto como punto de partida, él estableció una escala de temperatura absoluta, ahora llamada escala de temperatura kelvin.
Nótese que la escala de temperatura absoluta no tiene signo de grado, así que 25 K se llama 25 Kelvins. La única diferencia entre la escala de temperatura absoluta y la escala Celsius es que la posición del cero es diferente. Los puntos importantes de la escala se ajustan como sigue:
Cero absoluto: 0 K = -273.15°C
Punto de congelación del agua: 273.15 K = 0°C
Punto de ebullición del agua: 373.15K = 100°C
Fórmula para convertir de Grados Celsius a Kelvin
Entonces la relación °C y K es:T(K) = t(°C) + 273.15 °C
Con la ecuación anterior puedes convertir los grados Celsius a kelvin, es decir, se tiene que agregar 273.15 a la lectura en Celsius, la ecuación anterior se puede reescribir así;
K = (°C + 273.15°C) (1 K / 1°C)
El siguiente factor (1 K / 1°C) esta presente para hacer congruentes a las unidades en ambos lados de la ecuación, en la mayoría de los casos para ti como estudiante solo usaras 273 en lugar de 273.15.
Por conveniencia se usa T para denotar la temperatura absoluta (kelvin) y la t para indicar la temperatura Celsius, enseguida les muestro una tabla de la correspondencia en escalas Celsius y Kelvin:
La dependencia del volumen de un gas con la temperatura está dada por:
Volumen es proporcional a la Temperatura
V = k2T
V/T = k2
Donde k2 es la constante de proporcionalidad. La ecuación de arriba se conoce como ley de
Charles y de Gay-Lussac , o simplemente ley de Charles , la cual establece que el volumen
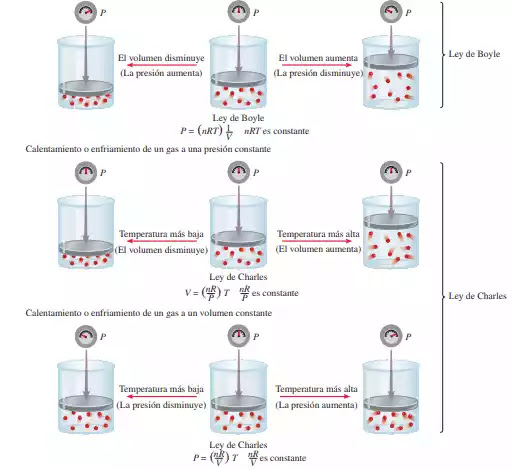
de una cantidad fija de gas mantenido a presión constante es directamente proporcional a la temperatura absoluta del gas. La ley de Charles también se ilustra en la imagen de abajo.
Observamos que el factor de proporcionalidad, k2, en la ecuación anterior es igual a nR/P.
Tal como hicimos para la relación presión-volumen a temperatura constante, podemos
comparar dos condiciones de volumen-temperatura para una muestra dada de un gas a
presión constante, se puede escribir así:
V1/T1= k2 = V2/T2
ó
V1/T1 = V2/T2
VER EJERCICIOS RESUELTOS
Donde V1 y V2 son los volúmenes de los gases a las temperaturas T1 y T2 (ambas en kelvins), respectivamente.
Otra forma de la ley de Charles muestra que para una cantidad de gas a volumen
constante, la presión del gas es proporcional a la temperatura
Presión es proporcional a la Temperatura
V = k3T
P/T = k3
Vemos que k3 = nR/V (Véase la imagen de arriba), y podemos reescribir la ecuación :
P1/T1= k3 = P2/T2
ó
P1/T1 = P2/T2
Donde P1 y P2 son las presiones del gas a temperaturas T1 y T2, respectivamente.
VER EJERCICIOS RESUELTOS





No hay comentarios.
SI DESEAS AYUDA Y HACES UN COMENTARIO ANONIMO, DEJANOS UN DATO PARA PODER CONTACTARTE Y PODER APOYARTE