![▷ Calculo del Rendimiento Real del agua en estado Gaseoso [Reactivos: 5g de H2 y 50g O2] ▷ Calculo del Rendimiento Real del agua en estado Gaseoso [Reactivos: 5g de H2 y 50g O2]](https://blogger.googleusercontent.com/img/a/AVvXsEjVmxSK3GFtwG1rOqzx5J7lg3xxOMC7HP8JR9iE67PFwyEDdWwPAmK_QITbqQABU0tgNf0V04n_VDmW2dB2Gvdg5tV3aypNEepTw5cZm85giT1VOdE0d5t9Jn6xbIBtzKWSsytidmjJ1xPOfdHI-uhUxpwL8CoUiEsRG_FW5q95PPAVdttHymU4iCEYwA=w600)
Calculas 100 y obtienes 80 | %Rendimiento
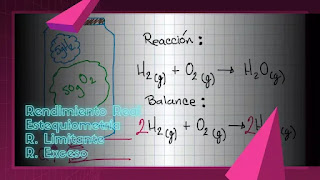
En un recipiente se coloca 5g de hidrógeno con 50 g de oxígeno, cambios en
estado gaseoso. se cierra el frasco y se calienta de tal forma que los gases
empiezan a reaccionar.
¿Qué masa de agua gaseosa se formará si el rendimiento de la reacción es
del 80%?
Fórmula para calcular el rendimiento de una reacción
%Rendimiento = (Rendimiento Real / Rendimiento Teórico) x 100 %
Donde:
%Rendimiento = 80%
Rendimiento real = Lo que se está preguntando
Rendimiento Teórico = Debemos calcular
Diagrama:
Pesos moleculares;
2 mol de H2(g) = 4 g de H2(g)
1 mol de O2(g) = 32 g de O2(g)
2 mol de H2O(g) = 36 g de H2O(g)
Según la reacción química
4 g de Hidrógeno reaccionan con 32 g de Oxígeno, de esta manera podemos notar que el Oxígeno esta en exceso, pues el
sistema se alimentó con 50 g de Oxígeno, aun así haremos el calculo
enseguida.
Calculando el reactivo limitante y el reactivo en exceso
Analogía
Si se tienen dos salchichas y un pan, únicamente se puede hacer 1 hotdog.
Los resultados de arriba nos dice que con 5 g de Hidrógeno (salchichas)
únicamente
podemos obtener 45 g de agua
(Hotdog).
Reactivo limitante: 5 g de Hidrógeno
Reactivo en Exceso: 50 g de Oxígeno
Calculando el Rendimiento real.
Despejando de la formula del %Rendimiento
Rendimiento Real = (%Rendimiento x Rendimiento Teórico) / 100%
Rendimiento Real = (80% x 45
g H2O(g) ) / 100%
Rendimiento Real = 36
g H2O(g)
Motivos por el cual el Rendimiento Real es menor al Rendimiento Teórico
- Las colisiones de los reactivos son escasas
- Efusión
- Evaporación
- Mal manejo del instrumento
- Método de separación
- Etc


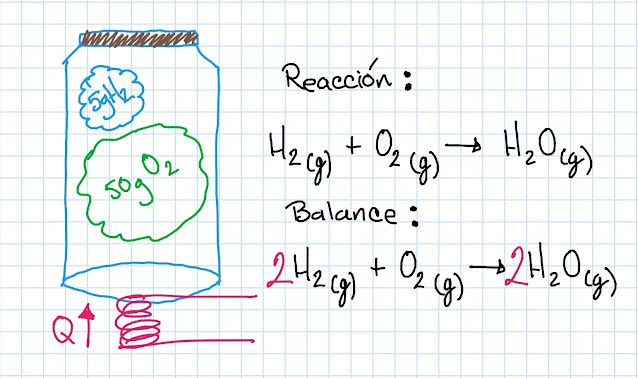

No hay comentarios.
SI DESEAS AYUDA Y HACES UN COMENTARIO ANONIMO, DEJANOS UN DATO PARA PODER CONTACTARTE Y PODER APOYARTE