
REDOX balance rápido...Wow!
Recuerden que en el balance redox, es importante tener en cuenta los
elementos en su estado natural, para éste caso es el Estaño (Sn) como
reactivo, esto se debe a que en el ajuste final del balance, es muy fácil
manipular estos elementos.
Video tutorial
Reacción química a balancear
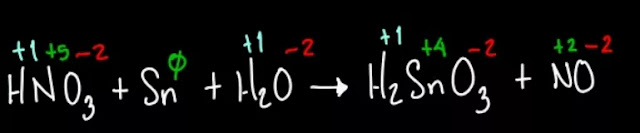
HNO3 + Sn + H2O → H2SnO3 +
NO
Estados de oxidación de los compuestos
Colocamos el número de oxidación a cada elemento;
Qué elemento cambió su estado de oxidación
Observemos cada elemento, atentamente en el número de oxidación y
separemos aquellos dos que sufrieron un cambio.
Quién se oxida y quien se reduce
Recuerda identificar el que se reduce primero, pues la propia palabra
da un significado y fácil de entender
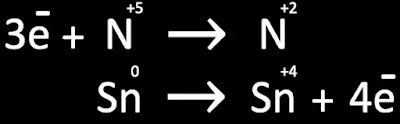
- El Sn se oxida, pues su valencia aumenta de 0 a +4
- El N se reduce , pues su valencia disminuye de +5 a 2
Agente reductor y agente oxidante
El agente reductor es el que se oxida (Estaño)
El agente oxidante es el que se reduce (Nitrógeno)
Balance de electrones
Como hacer la semireacción
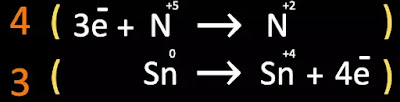
Tomamos los coeficientes del balance de electrones (el 3 y el 4) y los
cambiamos de fila;
Ahora multiplicamos cada coeficiente por su respectiva fila, respetando los
reactivos y productos de la reacción química;
Balance parcial
Colocamos cada coeficiente en el orden que la semireacción no ha dado y
comprobamos si la reacción química está balanceada;
4HNO3 + 3Sn + H2O → 3H2SnO3 + 4NO
4 - N - 4
6 - H - 6
3 - Sn - 3
13 - O - 13
BALANCEADA





No hay comentarios.
SI DESEAS AYUDA Y HACES UN COMENTARIO ANONIMO, DEJANOS UN DATO PARA PODER CONTACTARTE Y PODER APOYARTE