
Parece más tanteo que REDOX
En este ejercicio obtuvimos los coeficientes basado en los elementos que presenta REDOX, sin embargo en el ajuste final todo cambio, se hizo un "despapaye", pero logramos llegar al resultado con la pista que éste proceso nos facilitó.
Reacción química
KMnO4 + HCl → MnCl2 + KCl + Cl2 + H2O
Vamos a colocar el número de oxidación a cada elemento. Recomiendo colocar el número de oxidación de los oxígenos e hidrógenos en primer lugar;
Veamos qué elemento tiene una diferencia en su número de oxidación al pasar a los productos. Observando la reacción con número de oxidación de arriba el Mn y el Cl son los que participarán en el proceso REDOX;
Aquí podemos observar quién se oxida y quién se reduce, además quién es el agente reductor y oxidante.
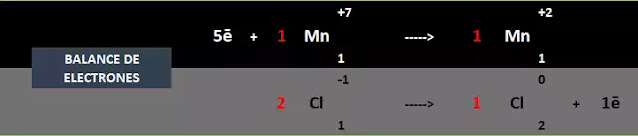
Balance de electrones
Ahora el balance de electrones. si tienes dudas de cómo hacer el balance de electrones te recomiendo veas esto primero;
Cruce de coeficientes
El 5 y el 1 salen del balance de electrones, estos números se les llama coeficientes estequiimétricos y en este paso cambian de fila;
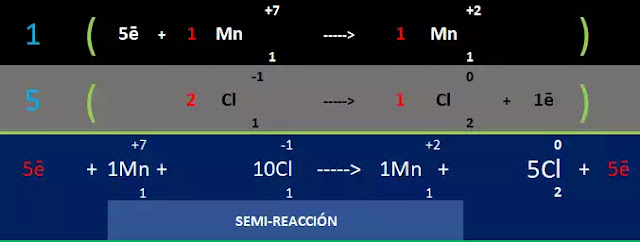
La semireacción
En este paso los coeficientes estequiométricos multiplicarán a la reacción parcial, enseguida los valores semejantes de anulan como los 5 electrones (5e);
1 Mn + 10 Cl → 1 Mn + 5Cl2
Sustitución de coeficientes y comprobación
KMnO4 + 10HCl → MnCl2 + KCl + 5Cl2 + H2O
1 - K - 1
1 - Mn - 1
10 - Cl - 10
10 - H - 2
4 - O - 1
NO BALANCEADA
Ajuste final de la reacción
En vista rapida podemos apreciar que ajustar el Oxígeno será complicado, por lo tanto ajustaremos al Oxígeno colocando un 4 al H2O, modificamos el 10 del HCl por un 8
KMnO4 + 8HCl → MnCl2 + KCl + Cl2 + 4H2O
1 - K - 1
1 - Mn - 1
10 - Cl - 10
5 - H - 2
4 - O - 1
NO BALANCEADA
Solo que da ajustar el Cloro en los productos, podemos usar una fracción (5/2);
KMnO4 + 8HCl → MnCl2 + KCl + (5/2)Cl2 + 4H2O
1 - K - 1
1 - Mn - 1
4 - O - 4
8 - H - 8
8 - Cl - 8
BALANCEADA
Ahora incluso podemos multiplicar toda la reacción por el denominador de la fracción (2) para tener solo números enteros;
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O
2 - K - 2
2 - Mn - 2
8 - O - 8
16 - H - 16
16 - Cl - 16
BALANCEADA



%2014.54.23.webp)


Igualar la siguiente reacción por el método de Óxido-
ResponderBorrarreducción, debe seguir los siguientes pasos:
Calcular los números de oxidación
Identificar el elemento que se oxida y el que se reduce
Plantear las semirreacciones
Poner los coeficientes en cada molécula de la reacción
igualada.
KMnO4+ FeCl2 + HCI -> MnCl2 + FeCl +.KC1+ H20
DALE EN EL BOTON QUIERO VER MAS REACCIONES Y ELIHE UN EJEMPLO REDOX PARA RESOLVER TU EJERCICIO
Borrarbusque otra y no me apareció
ResponderBorraro rayos hermano
BorrarYA QUEDO AHI ESTA
Borrar